 総力特集
総力特集
制御性T細胞
2025年10月6日,スウェーデンのカロリンスカ研究所は,ノーベル生理学・医学賞を大阪大学の坂口志文特任教授らに授与すると発表した。受賞理由は「末梢性免疫寛容の発見」,すなわち制御性T細胞の発見である。この細胞は,関節リウマチや1型糖尿病などの自己免疫疾患,アレルギー疾患,さらにはがん免疫療法まで,薬剤師が日常的に関わる多くの疾患の治療に革新をもたらす可能性を秘めている。今回,制御性T細胞の機能解析と治療応用の最前線で研究を進める志馬寛明先生,および坂口博士の研究室出身で制御性T細胞研究を継承・発展させている山崎小百合先生(名古屋市立大学 医学研究科 免疫学分野)に,制御性T細胞の基礎から最新の治療戦略までご解説いただいた。
 制御性T細胞とは
制御性T細胞とは
免疫系はさまざまな外敵(細菌,ウイルスなどの病原体)から,われわれの身を守るために備わっている生体防御の仕組みである。しかし,何らかの異常が起こって免疫細胞が自分自身(自己)の細胞や組織を敵とみなして反応するようになると,自己免疫疾患を引き起こしてしまう。それを防ぐために免疫系の働きを制御しているのが,制御性T細胞(regulatory T cell;Treg/Tレグ)である1)(表)。

表 T細胞の機能的分類と免疫応答における役割
制御性T細胞は強力な免疫抑制機能を備えており,他の免疫細胞が自己組織を攻撃(自己免疫応答)しそうになったときに,それを止めるブレーキの役割を果たす。免疫系が自己に応答しない現象は"自己寛容"とよばれ,健康な人ではその仕組みが正常に保たれているが,自己免疫疾患やアレルギーなど多くの疾患では制御性T細胞に異常がみられる2)。他にも,制御性T細胞は,感染した病原体に対する免疫応答を適切に調節し,病原体の排除後は速やかに免疫応答を沈静化させて,自己組織へのダメージが最小限になるようにしている。また,制御性T細胞は食餌や腸内細菌などの身体に無害な成分に対する免疫寛容や,妊娠時の胎児に対する母体の免疫寛容の維持にも関わる一方,がんに対する免疫応答を抑制することで,がんの進展を促進している。このように,自己・非自己にかかわらず,多様な抗原に対する免疫応答を制御性T細胞が制御している。
健常人において,制御性T細胞は末梢のCD4陽性T細胞の5~10%を占めており,CD25とFOXP3を強く発現することが特徴的である1)。FOXP3は,制御性T細胞の運命決定をするマスター転写因子であり,その遺伝子に変異があると制御性T細胞の発生や機能に異常が生じるため,重篤な自己免疫応答が起こる。ヒトの全身性自己免疫疾患であるIPEX(X染色体連鎖免疫制御異常多発性内分泌障害消化器病)症候群は,FOXP3遺伝子の突然変異により発症する。同様に,マウスでもFoxp3遺伝子に変異があると自己免疫応答による致死的な炎症が誘導される。これらのことは,制御性T細胞が生体維持に必要不可欠な存在であることを示している。
制御性T細胞の抑制機能は,細胞間接触(CTLA-4などの細胞膜分子が担う)や抑制性サイトカイン(IL-10,TGF-β)の分泌,T細胞の増殖に必要なサイトカインIL-2の枯渇(CD25が担う)などにより発揮される(図)。
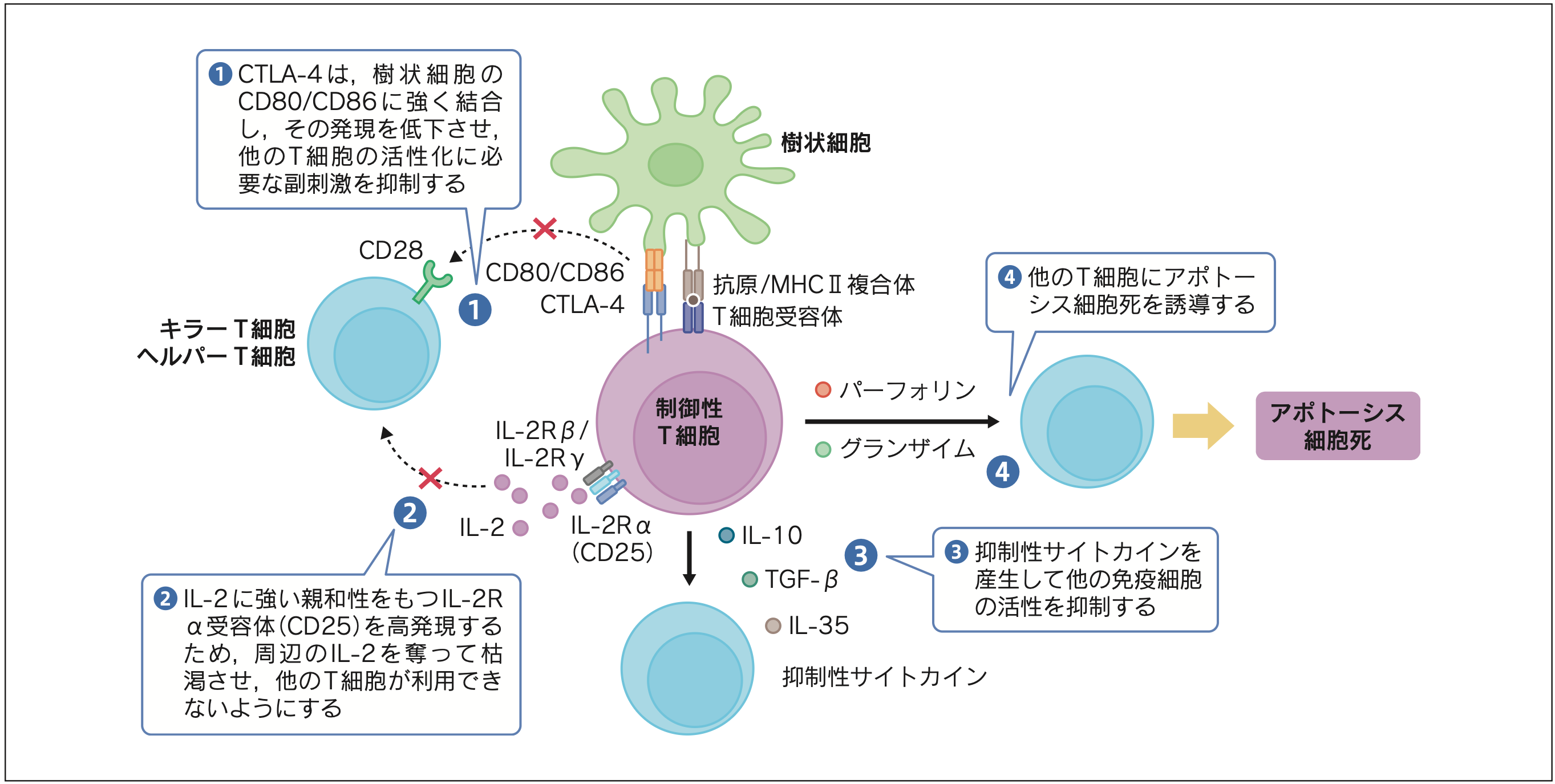
図 制御性T細胞による免疫抑制機構
このような多岐にわたるメカニズムによって,獲得免疫細胞(ヘルパー/キラーT細胞やB細胞)と自然免疫細胞(樹状細胞,マクロファージなど)の両方の免疫応答を"負"に制御する。
 ノーベル賞受賞の理由と背景
ノーベル賞受賞の理由と背景
2025年のノーベル生理学・医学賞は,「末梢性免疫寛容の発見」すなわち制御性T細胞の発見とFOXP3遺伝子の同定に対して授与された。受賞者は大阪大学の坂口志文博士と,米国の免疫学者であるMary Brunkow博士,Fred Ramsdell博士の3名である。博士らの研究は「免疫システムの自己制御メカニズムの解明」に決定的な貢献を果たし,なぜ免疫系が自己を攻撃しないのかという長年の疑問に答えを示した。その発見は自己免疫疾患の原因解明と治療法の開発につながる画期的な成果として,極めて高い評価を得ている。
制御性T細胞研究の歴史を振り返ると,坂口博士が1995年に発表した研究が大きな転機となった。当時,「免疫寛容は,胸腺で自己反応性のT細胞を除去する中枢性免疫寛容によって成立する」という説が主流であったが,坂口博士は末梢にも未知の寛容メカニズムが存在することを示した。マウスを用いた実験で,CD4陽性T細胞の中に自己免疫を抑制するサブセット(CD25を強発現する)が存在することを見出し,この細胞こそが「制御性T細胞」と命名される新たな免疫細胞であり,それまで謎とされていた末梢性免疫寛容の担い手であることを証明した3)。この発見により,当時の「抑制系のT細胞など存在しない」とする一部の懐疑的な見方が覆り,免疫学の常識が大きく書き換えられることとなった。
続いて,2001年にBrunkow博士,Ramsdell博士により自己免疫疾患を起こしやすいScurfyマウスの責任遺伝子がFoxp3であり,その遺伝子変異はIPEX症候群とも関連があることが突き止められた4)。そして,2003年には,坂口博士によりFoxp3が制御性T細胞の発生・機能維持に必須であることが示された5)。これらの一連の発見により,「免疫寛容の仕組みは胸腺でのT細胞の選別(中枢性寛容)のみならず,制御性T細胞による末梢での抑制(末梢性寛容)により成り立つ」と理解されるようになった。
これらの発見は単なる基礎研究上のブレークスルーにとどまらず,自己免疫疾患やアレルギー疾患の新たな治療法の開発に道を開いた。特に,制御性T細胞の発見は生体防御と疾患の理解を根本から刷新し,治療への応用を促進した点で極めて意義深いものといえる。
 制御性T細胞の治療応用への現状と展望
制御性T細胞の治療応用への現状と展望
基礎研究により明らかになったさまざまな知見をもとに,免疫疾患や移植医療,がん免疫療法の分野で,制御性T細胞の特性を利用した創薬・治療開発が精力的に進められている6)。制御性T細胞の機能不全が関与する疾患(1型糖尿病,関節リウマチ,炎症性腸疾患など)に対し,制御性T細胞を増強・活性化または移入することで病状を改善しようとする数多くの臨床研究が進められている。
また逆に,がん患者では腫瘍組織に制御性T細胞が集積しており,がん細胞が免疫の攻撃から逃避するために,制御性T細胞の働きを利用していると考えられている。そのため,がん免疫療法の分野では制御性T細胞の抑制・除去が新たな戦略として注目されている。ここでは,代表的なIL-2療法,CAR-Treg療法を中心に紹介する。
低用量IL-2療法
IL-2はT細胞増殖因子であるが,極低用量の投与により制御性T細胞だけを選択的に増殖させることができる。これは,制御性T細胞で高レベルに発現するCD25がIL-2に強い親和性を持つ受容体(IL-2Rα)であり,少量のIL-2を他の細胞よりも効率的に利用できるためである。この手法は全身性エリテマトーデス(SLE)や1型糖尿病など多数の自己免疫疾患で検討され,臨床症状の改善をもたらす可能性が示唆されている6)。また,移植片対宿主病(GVHD)の抑制を目的とした研究も進んでいる。低用量IL-2療法は比較的安全性が高く,既存のIL-2製剤の新たな使用法として応用しやすいことも利点である。
天然のIL-2をそのまま使用する低用量療法には,血中半減期が短いことや,用量調節が難しい場合に一部のエフェクター細胞も活性化してしまうリスクがある7)。そこで近年,IL-2分子を改変して選択的に制御性T細胞を刺激できるようにした新規医薬品候補が開発されている。例えば,IL-2の受容体結合部位に変異を入れて高親和性受容体(IL-2Rα/β/γの三量体)にのみ結合しやすくした「IL-2ムテイン(mIL-2)」や,さらにヒトIgGのFcドメインを融合させて血中持続時間を延長した製剤(mIL-2-Fc)が報告されている7),8)。また,部位特異的にポリエチレングリコール(PEG)化して体内での安定性を高めた製剤も開発されている9)。マウスやサルを用いた前臨床研究では,こうした改変IL-2製剤を用いて従来よりも安定的かつ選択的に制御性T細胞を増やし,移植片に対する免疫拒絶を抑制できることが示されている。現在,海外の製薬企業やアカデミア主導で臨床試験が進められており,難治性自己免疫疾患や臓器移植患者での免疫寛容誘導剤として期待が高まっている。
CAR-Treg療法
血液がんの治療で注目されたCAR-T細胞(キメラ抗原受容体CARを発現するT細胞)技術を,制御性T細胞に応用した治療法である。患者由来のT細胞にCARを遺伝子導入して作成したCAR-T細胞は,特定の細胞膜分子を発現する細胞を攻撃する能力をもつようになる。一方,制御性T細胞で同様に作製したCAR-Treg細胞は,ねらった抗原に対する免疫抑制効果を発揮することが期待される10)。例えば,アロ抗原(同一種内で免疫応答を引き起こす抗原であり,移植拒絶反応の原因となる)に特異的なCAR-Treg細胞は,GVHDの予防に有効となる可能性が示唆されている11)。CAR-Treg療法の利点は,多量のポリクローナル制御性T細胞(T細胞受容体に多くのバリエーションがあるために抗原特異性が低い)を用いる従来の方法に比べて少ない細胞数で強力かつ抗原特異的な免疫抑制が可能なため,全身性の免疫抑制(感染症リスク増大など)を抑えられる点である。しかし,安定性や安全性(他のCAR-T療法で問題となるサイトカイン放出症候群などを起こさないか)が担保されるかといった課題がある。
制御性T細胞を標的としたその他の免疫療法
その他にも,制御性T細胞を操作するために,さまざまな方法が考案されている。われわれは,紫外線の照射によって皮膚の制御性T細胞を増やすことが可能であり12),その結果,創傷治癒が促進されることを示した13)。また,制御性T細胞を増やすために,セリン・スレオニンキナーゼCDK8/19の阻害薬を用いて他のT細胞を制御性T細胞に再プログラミングする方法14)や薬剤カクテルを用いてiPS細胞から制御性T細胞を効率良く作製する方法が提案されている。一方,がんの進展を促進する腫瘍内の制御性T細胞を選択的に枯渇させるために,CCR8陽性制御性T細胞を除去するモノクローナル抗体を用いる方法や15),CD25を標的とした近赤外線免疫療法(NIR-PIT)も考案されている16)。
 おわりに
おわりに
発見から30年が経過し,制御性T細胞を標的とした免疫抑制薬や免疫増強薬の研究開発は,目覚ましい進展を遂げている。加えて,本稿では紹介できなかったが,制御性T細胞の役割は,組織修復や代謝など,免疫以外のさまざまな生体機能の調節にも及ぶことが報告されている17)。そのため,制御性T細胞を免疫関連疾患以外の疾患治療に利用する戦略も,免疫学領域を超えて多方面から注目を集めている。制御性T細胞による免疫学的・非免疫学的な作用と免疫細胞および非免疫細胞との相互作用を解き明かすことにより,さまざまな疾患に対する新たな治療法の開発につながると期待される。
引用文献
- Sakaguchi S,et al:Regulatory T Cells and Human Disease.Annu Rev Immunol,38:541-566,2020
- Yamazaki S:Diverse roles of dendritic cell and regulatory T cell crosstalk in controlling health and disease.Int Immunol,37:5-14,2024
- Sakaguchi S,et al:Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases.J Immunol,155:1151-1164,1995
- Brunkow ME,et al:Disruption of a new forkhead/winged-helix protein,scurfin,results in the fatal lymphoproliferative disorder of the scurfy mouse.Nat Genet,27:68-73,2001
- Hori S,et al:Control of regulatory T cell development by the transcription factor Foxp3.Science,299:1057-1061,2003
- Wardell CM,et al:Harnessing the biology of regulatory T cells to treat disease.Nat Rev Drug Discov,24:93-111,2025
- Efe O,et al:A humanized IL-2 mutein expands Tregs and prolongs transplant survival in preclinical models.J Clin Invest,134:e173107,2024
- Peterson LB,et al:A long-lived IL-2 mutein that selectively activates and expands regulatory T cells as a therapy for autoimmune disease.J Autoimmun,95:1-14,2018
- Ikeda M,et al:Targeted regulatory T cell activation by site-specific PEGylated interleukin-2 mitigates autoimmune inflammation.J Transl Autoimmun,11:100306,2025
- Zhang Q,et al:Chimeric antigen receptor(CAR)Treg:A promising approach to inducing immunological tolerance.Front Immunol,9:2359,2018
- MacDonald KG,et al:Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor.J Clin Invest,126:1413-1424,2016
- Yamazaki S,et al:Homeostasis of thymus-derived Foxp3+ regulatory T cells is controlled by ultraviolet B exposure in the skin.J Immunol,193:5488-5497,2014
- Shime H,et al:Proenkephalin+ regulatory T cells expanded by ultraviolet B exposure maintain skin homeostasis with a healing function.Proc Natl Acad Sci USA,117:20696-20705,2020
- Akamatsu M,et al:Conversion of antigen-specific effector/memory T cells into Foxp3-expressing Treg cells by inhibition of CDK8/19.Sci Immunol,4:eaaw2707,2019
- Kidani Y,et al:CCR8-targeted specific depletion of clonally expanded Treg cells in tumor tissues evokes potent tumor immunity with long-lasting memory.Proc Natl Acad Sci USA,119:e2114282119,2022
- Sato K,et al:Spatially selective depletion of tumor-associated regulatory T cells with near-infrared photoimmunotherapy.Sci Transl Med,8:352ra110,2016
- Muñoz-Rojas AR,et al:Tissue regulatory T cells:regulatory chameleons.Nat Rev Immunol,21:597-611,2021
